
在药厂设计中,GMP没有对工艺气体的质量标准进行定义,只规定进入无菌生产区的生产用气体(不包括可燃性气体)均应经过除菌过滤。用于无菌生产的公用介质(如压缩空气、氮气)的除菌过滤器和呼吸过滤器的完整性应定期检查。工艺气体的质量标准是由用户根据其具体用途和使用环境而决定的,当气体被用作辅料、工艺助剂或是药品制备过程中的一部分时,用户应评估其对产品的潜在影响。为了评估影响,可进行风险分析,可通过各种风险分析程序和方法来识别和评估关键质量属性和关键工艺参数。下面华盛兴邦谈下药厂设计中工艺气体设计的原则。
中国药典、欧盟药典、美国药典中有关于压缩空气、氮气、氧气、二氧化碳等气体的一些指标规定,但是这些是针对医用气体的,对于制药过程中的工艺气体不是很适用,但是可为用户在确定工艺气体的质量标准时提供参考,在这药厂设计的时候要非常注意。
ISO8573将压缩气体进行了等级划分,并推荐了测试方法。但是并没有推荐各等级压缩气体的适用范围。因此其仅仅是一个等级标准。
一、纯度
对于氮气、氧气等气体一般需要控制纯度(见图1)。纯度的计算方法有两种。
①使用特定的分析仪器直接测量。
②测量主要杂质的含量,从 100%中扣除。
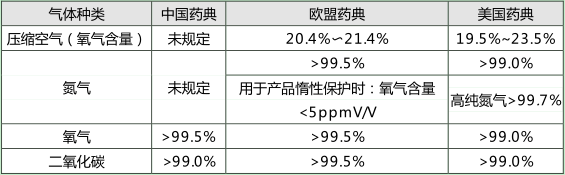
图1
二、含水量
控制水分将减低微生物在气体系统生长的风险。水分含量有很多种表示方法:湿度、质量含量(g/L)、露点等,这些表示方法之间有对应的关系,可以互相换算。图2 为医用气体的含水量要求。
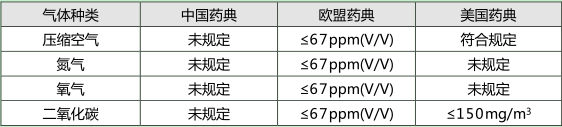
图2
三、含油量
含油量即碳氢化合物含量,它对于工艺用气来说是种污染物,如果存在于氧气系统中会有安全隐患,还会影响生物细胞培养过程。其主要来源于大气和制备过程中的设备润滑油蒸发。油含量只有欧盟药典关于医用压缩空气中有明确规定:<0.1mg/m 3 。
四、悬浮粒子和微生物
工艺气体需要控制其洁净度,具体的可接受标准需根据用户需求确定。一般认为,使用点的终端过滤器(0.22μm)能够满足无菌工艺的要求。非无菌的工艺用气可通过风险评估的方法来确定。
这些气体的验证与用来生成气体的设备验证都类似,这些气体的储存及分配必须首先经过调试并随后经过确认。设备的安装确认与运行确认的汇总报告获得批准之后分配系统可以经过确认。注意,仪表用空气仅仅需要通过运行确认来测试,因为它不与产品接触。